El control de atmósferas explosivas no sólo depende de la correcta ventilación, sino del conocimiento de líquidos que se evaporan.
Por: Ing. Álvaro Gómez Trejo e Ing. José Carlos Galindo Santoyo.
Puede resultar útil definir algunos conceptos y exponer los comportamientos de líquidos, vapores y gases en circunstancias de inflamabilidad y explosión para exponer después el control que puede ejercerse con la ventilación adecuada de atmósferas conteniendo tales elementos.
En teoría, los ambientes explosivos sí existen, pero los líquidos en sí no son inflamables, sino que los vapores desprendidos provocan fuego o explosión con una llama o chispa. Sin embargo para que se dé uno de estos eventos los vapores necesitan una determinada proporción de aire y la presencia de una fuente de ignición para entrar en inflamabilidad (véase figura inicial).
Así, en el caso de gasolina, que no es el único líquido que emite gases inflamables, sus vapores deben estar presentes entre 1.4% y 7.6% en un volumen de aire para explosionar. Por ello, es necesario mantener la gasolina líquida en recipientes y reducir al máximo su contacto con el aire durante su manejo.
Las técnicas de prevención de incendios y explosiones se basan en eliminar fuentes de ignición, evitar contacto con el aire, hacer almacenaje de líquidos, emplear atmósferas de gas inerte y ventilación adecuada para diluir las mezclas e impedir concentraciones de gases inflamables.
Punto de inflamación, temperatura de ignición, límites de inflamabilidad, índice de evaporación, reactividad al calor, densidad e índice de difusión de otros factores deben tenerse en cuenta para evaluar correctamente el riesgo al que se está expuesto. Además cuando el incendio se ha declarado o la explosión provocado, todos estos factores pierden importancia y el control del siniestro pasa a otro nivel.
Clasificación. La National Fire Protection Association (NFPA) define un líquido como un fluido con presión de vapor inferior a 172 kPa a 38°C. Otra clasificación establece categorías de líquidos inflamables como: metano, propano, etileno e hidrógeno.
Muchos productos combustibles son sólidos a 38°C o más pero al calentarse se transforman en líquidos que emiten vapores inflamables. Ceras, pulimentos y otros similares deben considerarse bajo el punto de vista de los líquidos y vapores a los que dan lugar al calentarse.
Atmósfera explosiva. Es toda mezcla de aire, en condiciones atmosféricas, de sustancias inflamables en forma de gas, vapor, niebla o polvo donde tras una ignición, la combustión se propaga a la totalidad de la mezcla no quemada. La temperatura de inflamación está definida por ensayos normalizados según CEI-79-4.
Atmósfera potencialmente explosiva. Se le llama así cuando el riesgo sólo existe en estado potencial, esto es, que la atmósfera pueda derivar a explosiva debido a condiciones locales y de funcionamiento.
Punto de inflamación y temperatura de autoignición de un líquido
Corresponde a la temperatura más baja a la que la presión de vapor del líquido puede producir una mezcla inflamable en el límite inferior de inflamabilidad, es decir, sin vapor no hay inflamación, y a más temperatura más vapor. Hay temperatura mínima a la que existe suficiente vapor para inflamar; este es el punto de inflamación, que puede ser determinado con la utilización de aparatos normalizados para realizar ensayos.
Por su parte, la temperatura de autoignición de un líquido es aquella a la que debe calentarse un líquido para entrar en ignición espontánea y arder. Para determinar este punto también existe un método normalizado.
En general la temperatura de ignición disminuye al aumentar el peso molecular del líquido.
Límites de explosividad
Se define el límite inferior de explosividad (LIE), como la concentración mínima de vapor-aire debajo de la que el fuego no se propaga. En consecuencia el límite superior de explosividad (LSE), es la máxima concentración de vapor-aire por encima de la cual que el fuego no se propaga.
Bajo el LIE se considera que la mezcla es demasiado pobre para arder y por encima del LSE es demasiado rica para hacerlo (p.e. en motores de explosión, se dice que se ahoga).
Los límites de explosividad están fuertemente influidos por la temperatura y presión a las que se somete el líquido inflamable. Los vapores que flotan sobre un líquido se reducen al aumentar la presión opuesta a la vaporización y aumentan al descender ésta. También, al aumentar la temperatura el líquido tendrá mayor presión de vapor tendiendo a evaporarse más. El punto de equilibrio sólo puede alcanzarse obviamente en sistemas cerrados como tanques, tuberías, etc. Al aire libre el líquido vaporizable continuaría evaporándose hasta su total agotamiento.
Energía necesaria para la ignición de vapores
Las fuentes de ignición pueden ser muy diversas, incluyendo: calor producido por rozamientos en máquinas con funcionamiento anormal, desgastes, roturas, etc.; superficies calientes, con dimensiones y temperatura suficientes para poder inflamar; llamas capaces de calentar el vapor hasta la temperatura de ignición de la mezcla; y chispas producidas por fricción de corta duración, pueden no llegar a inflamar mezclas. Las chispas eléctricas, en cambio, sí tienen energía suficiente y son capaces de producir ignición de las mezclas inflamables.
Por compresión
Pueden provocarse explosiones muy destructivas a menos que estén controladas y dirigidas como es el caso dentro de los cilindros de motores Diesel, donde la compresión rápida de una mezcla inflamable, de gasoil, genera el calor suficiente hasta su punto de ignición.
La tabla al final del artículo contiene una lista de productos con indicación de sus características físicas y los límites de explosividad LIE y LSE. También se expresa la máxima concentración aceptable para la vida humana (MAC). Es un dato muy necesario al tratarse de atmósferas en recintos cerrados, naves o armarios en procesos industriales donde exista presencia humana ya que la ventilación de una atmósfera para asegurar su nulo riesgo de explosión puede no ser suficiente para la salud de los ocupantes.
Conocer las características físicas y límites de explosividad LIE y LSE de los productos utilizados es de vital importancia para su correcto manejo. Además provee información acerca de sus máximas concentraciones aceptables para la vida humana, dato necesario cuando se trabaja con dichos productos en espacios cerrados, para instalar la ventilación adecuada.
Los vapores precisan de una determinada proporción de aire y la presencia de una fuente de ignición para inflamarse. Por ello es de vital importancia, saber cómo, cuándo y en dónde utilizarlos para no provocar accidentes.
La ventilación en estos casos realiza una misión indispensable evitando atmósferas potencialmente explosivas, que se encuentran por debajo del LIE (Límite Inferior de Explosión), ayudando a disminuir el riesgo y diluyendo los aportes de gases o vapores producidos.
Esta teoría es de vital importancia en procesos industriales que tienen lugar en hornos, estufas y secadoras. El cálculo resulta fácil si la cantidad de solvente es conocida.
| La fórmula para saber el caudal de aire que debe aportar la ventilación es: | ||
| Q (m3/h) = | 22,4 x P x 100 x C x W | |
| Pm x LIE x B | ||
x
| Por consiguiente: | |
| Pe | = Peso específico del solvente. |
| Pm | = Peso molecular del solvente. |
| C | = Coeficiente de seguridad entre 4 y 12. |
| S | = Litros/hora del solvente a diluir. |
| LIE | = Límite Inferior Explosividad %. |
| B | = Constante igual a 1 para temperaturas hasta 120 ºC. Para temperaturas superiores debe tomarse =0,7 |
x
Una vez conocido el resultado del valor de este caudal de ventilación, se mueven las bocas de extracción cerca de los focos contaminantes, además el circuito de aire establecido deberá pasar por la zona nociva para arrastrar los vapores perjudiciales que llegarán al exterior sin atravesar los lugares ocupados por las personas. Las bocas de salida se situarán alejadas, ya que no se permite el regreso del aire una vez salido.
Por lo general, la situación antes mencionada, no es propicia en lugares con afluencia de personas. En caso de que se diera así, el cálculo debe hacerse teniendo la máxima concentración del tóxico permitida para los humanos (a este término se le conoce como MAC). El cálculo MAC depende de lo dañino del producto, la uniformidad de su distribución y de la situación del ventilador que determina la dirección de arrastre del contaminante, así su valor se toma entre 3 y 10%.
| La fórmula anterior reviste la forma: | ||
| Q (m3/h) = | 22,4 x Pe x 100 x C x K | |
| Pm x MAC | ||
x
| En donde: | |
| K | = 3 a 10. |
| MAC | = Máxima concentración aceptable en %. |
x
El cálculo arriba mencionado debe efectuarse con los valores máximos de LIE y MAC, que puede encontrar en la tabla publicada en la primera parte de este texto.
Si hay mezcla de gases se puede considerar la mezcla como formada por un sólo componente con el LIE más bajo, es decir, utilizando el mayor caudal de aire. Si se desea hacer un cálculo más preciso puede usarse la fórmula de Le Chatelier.
| fórmula de | __ _100 X |
| Le Chatelier | %2 + %3 +… |
| LIE2 LIE3 |
x
En donde % es el equivalente en peso del componente en la mezcla.
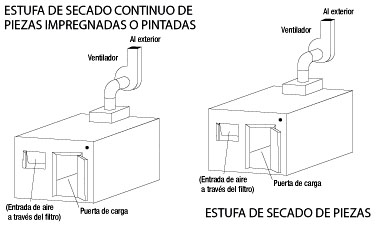 Ejemplo 1: Estufa de secado de piezas estáticas pintadas o barnizadas:
Ejemplo 1: Estufa de secado de piezas estáticas pintadas o barnizadas:
Piezas barnizadas deben secarse en una estufa a 175°C. El disolvente volátil es Tolueno del que se evapora un litro por hora de forma uniforme (esto es importante: uniformemente a lo largo de una hora). ¿Qué caudal de aire exterior, puro, necesitamos para diluir los vapores de Tolueno por debajo de su Límite Inferior Explosivo?
| Q (m3/h) = | 22,4 x Pe x 100 x S x C | |
| Pm x LIE x B | ||
| X | ||
| 22,4 x 0,866 x 100 x 10 x 1 = 237 m3/h | ||
| 92,12 x 1,27 x 0,7 | ||
x
Como esta fórmula se refiere a condiciones normales se aplicará la ley de charles y gay lusac para conocer el caudal necesario a 175°c a que trabaja la estufa:
| Q2 = Q1 | t2 + 273 |
| t1 + 273 | |
| X | |
| = 273 | 175 + 273 = 362 m3/h |
| 20+273 |
x
Este caudal, 360 m³/h aproximadamente, es el que deberá proporcionar el sistema de ventilación de la estufa. Es decir, insuflar 360 m³ de aire cada hora, de forma uniforme, continuada o bien extraer este mismo volumen horario, previendo la entrada de aire a través de un filtro en todo caso.
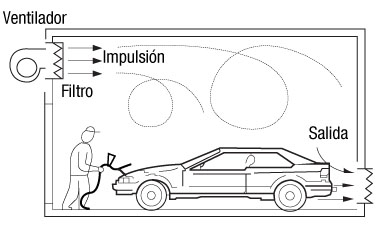 Ejemplo 2: Cabina de pintura a pistola:
Ejemplo 2: Cabina de pintura a pistola:
Cuando se pinta en cabinas o sitios cerrados el valor LIE y el MAC, deben ser calculados con precisión, ya que representa una atmósfera potencialmente explosiva.
Una cabina de pintura a pistola para coches, manual, con los operarios pintores dentro de la misma, que evapora dos litros de Xylol por hora, trabajando a temperatura ambiente. ¿Qué caudal de aire precisa para diluir el contaminante?
| Q = | 22,4 x 0,881 x 100 x 8 x 2 = 300 m3/h | |
| 106,16 x 1 x 1 | ||
x
Pero como la cabina de pintura está ocupada por seres humanos, deberemos calcular el caudal necesario para diluir el contaminante a valores de la Máxima Concentración Aceptable (MAC), para lo que resulta:
| Q = | 22,1 x P x 106 x S x K = | ||
| Pn x MAC | |||
| X | |||
| x = | 22,4 x 0,881 x 106 x 2 x 6 = | ||
| 106,16 x 100 | |||
| X | |||
| = 22.300 m3/h | |||
x
Ejemplo 3: Vehículos dentro de un estacionamiento:

En un estacionamiento la afluencia de vehículos es notoria, sin embargo no importa cuantos sean, el nivel de riesgo resulta alto, ya que estos, desechan de sus motores al ambiente múltiples componentes, inclusive carburantes de gasolina y sus vapores que dan como resultado atmósferas explosivas. La ventilación en estos casos debe de ser obligatoria y precisa para no ocasionar desastres, este cálculo debe hacerse también para diluir los gases y vapores producidos por su MAC.
En este caso, como la seguridad para la salud de los operarios exige 22.300 m³/h, muy superior a los 300 que se necesitan para prevenir explosiones, se ventilará en función de la Higiene Industrial con lo que quedará sobradamente protegida la instalación contra el peligro de explosión.
Las mezclas de aire y gases inflamables pueden explotar al alcanzar su temperatura de inflamabilidad. Basta con que una pequeña parte de la mezcla alcance esta temperatura para que se produzca la ignición o la explosión, propagándose a alta velocidad. Generalmente la causa de la explosión es una chispa en contacto con el gas.
La explosión solamente ocurre cuando el gas inflamable está presente en una proporción determinada en el aire o el oxígeno. Por ejemplo:
» Una mezcla de aire y metano (grisú) solamente es explosiva si el contenido de metano sobrepasa 5.3 %.
» Una de hidrógeno y aire lo es cuando el contenido es mayor a 4.1 %.
» El acetileno sólo explota en el aire cuando su contenido está comprendido entre 2.8 y 65%.
» Los límites de detonación para una mezcla de aire y monóxido de carbono son de 15 a 75%.
» Aire y gas del alumbrado: 10 – 20%.
» Aire y benceno: 1 – 60%.
» Aire y amoníaco: 16 – 27%.
Cuando los vapores de muchos disolventes volátiles se mezclan con el aire en determinadas proporciones, también son inflamables y pueden ocasionar explosiones. Se vaporizan grandes cantidades de disolventes cuando se pinta a pistola objetos grandes y pequeños, cuando se desengrasan objetos metálicos, etc.
 Ejemplo 4: Granjas de animales e invernaderos:
Ejemplo 4: Granjas de animales e invernaderos:
Los gases y vapores que expelan los animales y las plantas son muy peligrosos ya que se acumulan en las granjas e invernaderos, sobre todo los gases carburantes líquidos y gaseosos de los sistemas de calefacción. Es por ello, que el cálculo de la ventilación es necesario para su salud.
Debe tomarse en cuenta dicho control para que estos ambientes se encuentren por debajo del LIE evitando con la ventilación que se sobrepase el límite.
| LISTA DE PRODUCTOS CON INDICACIÓN DE SUS CARACTERÍSTICAS FÍSICAS Y LOS LÍMITES DE EXPLOSIVIDAD LIE Y LSE. | ||||||
| MATERIAS | PESO MOLECULAR | DENSIDAD | LÍMITES DE EXPLOSIVIDAD PORCENTAJE % EN VOLUMEN | MÁXIMA CONCENTRACIÓN MAC | ||
| INFERIOR LIE | SUPERIOR LSE | P.P.M. | MG/M³ | |||
| Acetaldehído | 44,05 | 0,821 | 3,97 | 57,00 | 100 | 180 |
| Acetato de etilo | 88,10 | 0,901 | 2,18 | 11,40 | 400 | 1.400 |
| Acetato de metilo | 74,08 | 0,928 | 3,15 | 15,16 | 200 | 610 |
| Acetato de n-propilo | 102,13 | 0,886 | 1,77 | 8,00 | 200 | 835 |
| Acetato de n-amilo | 130,18 | 0,879 | 1,10 | – | 100 | 532 |
| Acetato de n-butilo | 116,16 | 0,882 | 1,39 | 7,55 | 150 | 713 |
| Acetona | 58,08 | 0,792 | 2,55 | 12,80 | 1.000 | 2.400 |
| Acido acético | 60,05 | 1,049 | 5,40 | – | 10 | 25 |
| Acrilonitrilo | 53,06 | 0,806 | 3,05 | 17,00 | 2 | 4,3 |
| Alcohol etílico | 46,07 | 0,789 | 3,28 | 18,95 | 1.000 | 1.900 |
| Alcohol isoamílico | 88,15 | 0,812 | 1,20 | – | 100 | 361 |
| Alcohol isopropílico | 60,09 | 0,785 | 2,02 | 11,80 | 400 | 983 |
| Amoníaco | 17,03 | 0,597 | 15,50 | 27,00 | 25 | 18 |
| Anhídrido sulfuroso | 64,07 | 2,264 | – | – | 5 | 13 |
| Anhídrido acético | 102,09 | 1,082 | 2,67 | 10,13 | 10 | 25 |
| Anhídrido carbónico | 44,01 | 1,53 | – | – | 5.000 | 9.000 |
| Anilina | 93,12 | 1,022 | 75,6 | – | 5 | 19 |
| Benceno | 78,11 | 0,879 | 1,4 | 7,10 | 10 | 30 |
| Bromo | 159,83 | 3,119 | – | – | 0,1 | 0,7 |
| Bromuro de etilo | 109,98 | 1,43 | 6,75 | 11,25 | 200 | 891 |
| Bromuro de metilo | 94,95 | 1,732 | 13,50 | 14,50 | 20 | 80 |
| Butadieno | 54,09 | 0,621 | 2 | 11,50 | 10 | 22 |
| Butano | 58,12 | 2,085 | 1,86 | 8,41 | 800 | 1.900 |
| Butanol | 74,12 | 0,810 | 1,45 | 11,25 | 100 | 300 |
| Butanone | 72,1 | 0,805 | 1,81 | 9,50 | 200 | 590 |
| Cianuro de hidrógeno | 27,03 | 0,688 | 5,60 | 40,00 | 10 | 11 |
| Ciclohexano | 84,16 | 0,779 | 1,26 | 7,75 | 300 | 1.030 |
| Ciclopropano | 42,08 | 0,720 | 2,40 | 10,40 | – | – |
| Cloro | 70,91 | 3,214 | – | – | 1 | 3 |
| Cloroformo | 119,39 | 1,478 | No inflamable | 10 | 50 | |
| Cloruro de etilo | 64,52 | 0,921 | 3,6 | 14,80 | 1.000 | 2.640 |
| Cloruro de metilo | 50,49 | 1,785 | 8,25 | 18,70 | 50 | 103 |
| Cloruro de vinilo | 62,50 | 0,908 | 4,00 | 21,70 | 500 | 1.300 |
| Dicloroetileno | 96,95 | 1,291 | 9,7 | 12,80 | 5 | 20 |
| Diclorometano | 98,97 | 1,257 | 6,2 | 15,9 | 50 | 174 |
| Dicloruro de propileno | 112,99 | 1,159 | 3,4 | 14,5 | 75 | 347 |
| Disulfido de carbono | 76,13 | 1,263 | 1,2 | 50 | – | – |
| Estireno | 104,14 | 0,903 | 1,1 | 6,1 | 50 | 213 |
| Eter etílico | 74,12 | 0,713 | – | – | 400 | 1.200 |
| Etoxietanol | 90,12 | 0,931 | 2,6 | 15,70 | 5 | 18 |
| Formaldehído | 30,03 | 0,815 | 7,0 | 73,00 | 5 | 6 |
| Formiato de etilo | 74,08 | 0,917 | 2,75 | 16,40 | 100 | 303 |
| Formiato de metilo | 60,05 | 0,974 | 4,5 | 20,00 | 100 | 246 |
| Fosfamina | 34,00 | 1,146 | – | – | 0,3 | 0,4 |
| Gasolina | 86 | 0,68 | 1,3 | 6,00 | 300 | 890 |
| Heptano | 100,20 | 0,684 | 1,1 | 6,70 | 400 | 1.640 |
| Hexano | 86,17 | 0,66 | 1,18 | 7,40 | 100 | 360 |
| Metanol | 34,04 | 0,792 | 6,72 | 36,50 | 200 | 260 |
| Metilpropilcetona | 86,13 | 0,816 | 1,55 | 8,15 | – | – |
| Monóxido de carbono | 28,10 | 0,968 | 12,5 | 74,20 | 50 | 55 |
| Octano | 114,22 | 0,703 | 0,95 | 3,2 | 300 | 1.450 |
| Ozono | 44,05 | 0,887 | 3,00 | 80,00 | 1 | 1,8 |
| Oxido de etileno | 48,00 | 1,658 | – | – | 0,1 | 0,2 |
| Pentano | 72,15 | 0,625 | 1,40 | 7,80 | 600 | 1.800 |
| Percloroetileno | 165,85 | 1,624 | No inflamable | 100 | 670 | |
| Propano | 44,09 | 1,554 | 2,12 | 9,35 | – | – |
| Sulfuro de carbono | 76,13 | 1,263 | 1,25 | 50,00 | 20 | 60 |
| Sulfuro de hidrógeno | 34,08 | 1,189 | 4,3 | 45,50 | 10 | 14 |
| Tetracloruro de carbono | 153,84 | 1,595 | No inflamable | 10 | 65 | |
| Tolueno | 93,12 | 0,866 | 1,27 | 6,75 | 100 | 375 |
| Tricloroetileno | 131,40 | 1,466 | No inflamable | 100 | 535 | |
| Xileno | 106,16 | 0,881 | 1,0 | 6,00 | 100 | 435 |
——————————————————————————————————-
Fuente: Soler&Palau